I den siste uken av mars i 2009 kom to barn i Sør-California med influensa. De var 9 og 10 år gamle, en jente og en gutt, og selv om det var veldig sent i influensasesongen, hadde de begge læreboksymptomer: plutselig feber, en hoste og slag-av-en-lastebil. Barna hadde ingen tilknytning til hverandre - familiene deres bodde i tilstøtende fylker i bunnen av staten - men ved en tilfeldighet tok begge klinikkene foreldrene deres tok dem med til å delta i influensasporingsprosjekter som ble drevet av Centers for Disease Control og Forebygging, det amerikanske føderale byrået som overvåker sykdomstrusler hjemme og rundt om i verden.
Det var en heldig ulykke, fordi det betydde at begge barna fikk svelget strupen for å sjekke hvilken av de flere influensastammene som sirkulerer hvert år som gjorde dem syke. Men det som virket som et rutinemessig første skritt, ble raskt en alarmkilde. De to barna, som bodde mer enn 100 mil fra hverandre, presenterte stammer som var veldig like hverandre - men det var en ny type influensa, og basert på genetiske bevis hadde den opphav i griser. En influensastamme som hopper fra en dyreart for å infisere mennesker er et signal for problemer; et virus som menneskets immunsystem aldri har opplevd, er mer sannsynlig å forårsake alvorlig sykdom og død.
Mindre enn to uker etter at testresultatene kom inn erklærte USA en nasjonal krise for folkehelsen. Stammen spredte seg raskt over hele verden, og panikk fulgte. I juni, som tilfeller montert over hele verden, erklærte Verdens helseorganisasjon at en influensapandemi - det første av det 21. århundre - hadde begynt.
Nesten så snart prøvene ble analysert, klarte CDC å isolere den nye stammen og bruke den som grunnlag for en nødvaksine. Men influensavaksinateknologi er tiår gammel og klumpete, og det nye viruset samarbeidet ikke, reproduserte seg dårlig og bremset den tungvint prosessen. Hele sommeren og utover høsten angrep engstelige foreldre og leger barneleger og medikamentprodusenter og ba om vaksine som ikke eksisterte ennå. De første dosene ble ikke publisert før i oktober, etter at titusenvis i USA hadde blitt syk og 60 barn hadde dødd. Antall tilfeller rapportert av leger toppet i slutten av oktober. I januar var det endelig nok vaksine til å beskytte alle i landet som vanligvis ville bli vaksinert, nesten 120 millioner doser. Men publikum hadde mistet interessen, og mer enn en fjerdedel av den hastig fremstilte vaksinen - verdt hundrevis av millioner av dollar - ble ødelagt.
Influensaen fra 2009 viste seg ikke å være den alvorlige faren som helsemyndighetene fryktet. Millioner av mennesker ble syke over hele verden, men deres sykdommer var for det meste milde. Mellom 151.700 og 575.400 mennesker døde - men selv om det virker som et stort antall, var det på nivå med en gjennomsnittlig influensasesong. Den verste innvirkningen var ikke liv og helse, men publikums tillit til influensavaksiner. Episoden ble avsluttet med at helsemyndighetene gjorde nye anstrengelser for å endre måten influensaskudd blir gjort og distribuert fundamentalt.
Og nå har de kanskje et glimt av en sjanse.
**********
En vaksine for alle årstider
For å beskytte mot fremtidige influensaepidemier går forskere utover det vanlige skuddet i armen. - Forskning av Sonya Maynard

 (Matthew Twombly)
(Matthew Twombly) 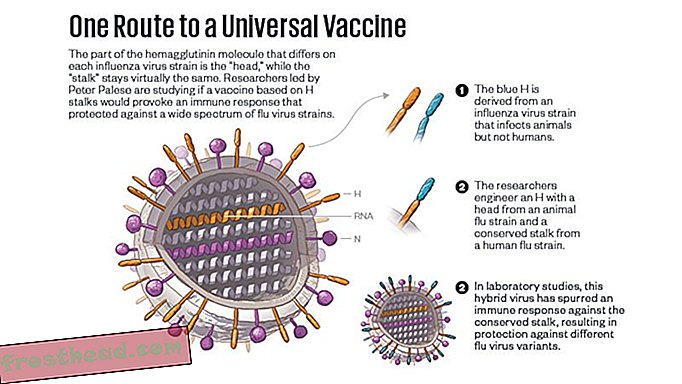 (Matthew Twombly)
(Matthew Twombly) 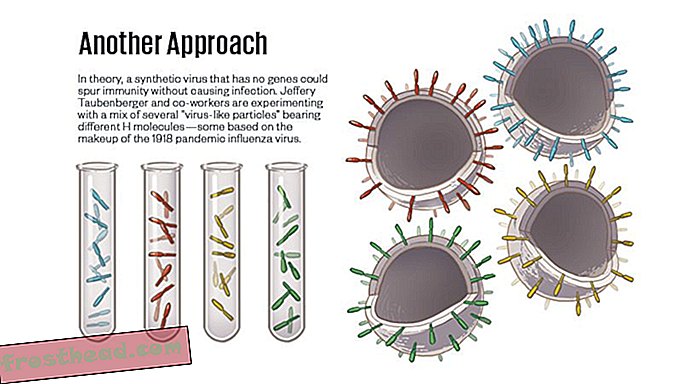 (Matthew Twombly)
(Matthew Twombly) I de siste dagene av juni i år samlet en falanx av influensaforskere fra hele verden seg i et slankt konferanseområde med glassvegg i en blindvei i forstads Maryland. Jeg var den eneste reporteren som deltok på dette bare invitasjonen, arrangert av National Institutes of Health. Forsamlingen hadde mer i bakhodet enn bare å fremskynde levering av vaksine. Målet var å undersøke om influensa skudd kunne fullstendig gjenopprettes, fra en formel skrevet og levert fersk hvert år til en som kunne gis hvert tiende år, eller til og med en eller to ganger i løpet av en levetid: en universell vaksine.
Anthony Fauci, direktør for National Institute of Allergy and Infectious Diseases, åpnet møtet, som fikk tittelen “Pathway to a Universal Flu Vaccine.”
"Nåværende sesongmessige influensavaksiner er ikke konsekvent effektive, " sa han til de omlag 175 fremmøtte. "Vaksine mot meslinger, kusma og røde hunder er 97 prosent effektiv; vaksine mot gulfeber er 99 prosent effektiv. [Influensavaksine] kan være så lavt som 10 prosent. ”I influensasesongen som ble avsluttet våren 2017, sa han, hadde vaksinen forhindret sykdom hos bare 42 prosent av personene som tok den.
Disse tallene kan komme som en overraskelse når du tenker på hvor aggressiv folkehelse oppmuntrer influensavaksinen. CDC anbefaler at alle amerikanske innbyggere som er 6 måneder eller eldre og ikke har en allergi mot noen av ingrediensene, skal motta vaksinen hver influensasesong, og hvert år produserer produsenter så mange som 166 millioner doser for å mate den etterspørselen. Du kan ikke gå inn i et supermarked eller et apotek om høsten uten å bli oppfordret til å ta skuddet. Store kampanjer på arbeidsplassen ber de ansatte ta den, og skolene reklamerer for vaksinen for barn som kan smitte nyfødte eller utsatte besteforeldre, i tillegg til at de blir syke selv.
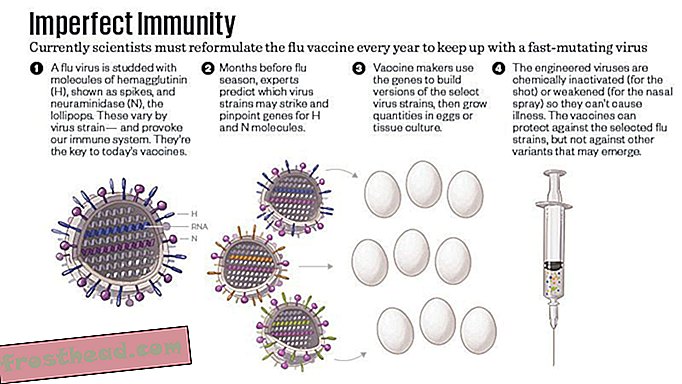
Det er nettopp på grunn av influensas uforutsigbarhet at myndighetene presser influensavaksinen så hardt. Meslingviruset som sirkulerer i verden nå er det samme som det som eksisterte for 10 år siden, eller 20 eller 50. Men influensa endres fra sesong til sesong, for når den reproduserer, gjør den konstant små feil i sin genetiske kode. Virusene blomstrer i det kalde været, og sykler frem og tilbake over ekvator hver vår og høst. Som en ny utrulling av influensasongen analyserer planleggere de sirkulerende virusene for å forutsi hva som kan skje når sykdommen går mot den andre polen igjen, og skriver en vaksineformel som passer.
Fremstilling av influensavaksine er en langsom prosess. Virusene som planleggerne velger best og representerer det som kan komme - det er vanligvis tre, og i noen formler fire - settes de inn i et medium som lar dem reprodusere seg i store mengder. (Historisk sett brukte vaksineutviklere millioner av befruktede kyllingegg, men nå inkuberer de noen ganger virusene i lab-dyrkede celler fra dyr eller insekter.) Deretter deaktiverer de viruset, for den injiserbare vaksinen, eller svekker det, for nesesprayen. Det kan ta seks måneder å dyrke nok virus og teste og pakke en vaksine. I den tiden kan influensas rastløse mutabilitet sende en sesongstamme i en retning som ingen forventet, og redusere beskyttelsen som planleggere håpet på da de skrev vaksineformelen et halvt år før.
I følge CDC dør mellom 12.000 og 56.000 mennesker av influensa hvert år bare i USA, og opptil 710.000 flere blir syke nok til å bli lagt inn på sykehus. Disse tallene består av personer som nekter vaksinen, og de som ikke kan ta den på grunn av allergi mot en av komponentene. Men de inkluderer også personer som var vaksinert, men endte opp med å ikke bli beskyttet fordi det sirkulerende viruset ikke samsvarte med forventningene.
Det er bompengene i gjennomsnittlige år, når viruset har endret seg akkurat nok - "drevet" er den tekniske betegnelsen - for å kreve at produsentene justerer forrige års vaksineformel litt. Men noen få ganger et århundre, på tvers av uforutsigbare tidsforløp, driver ikke viruset, men skifter til en form som er så ny at den eksisterende vaksinen ikke brukes som base for en ny, og tidligere infeksjon gir ingen forsvar. Når en influensa som den kommer i gang, er resultatet en pandemi.
1918-influensa var mor til alle influensapandemier. Men det var også pandemier i 1968 og 1957, som drepte minst en million mennesker hver - og basert på historiske beretninger, men uten mikrobiologi for å bekrefte dem, i 1889, 1847, 1830, 1781, og så langt tilbake som en epidemi av "gispe undertrykkelse" i 1510. Influensaviruset ble bare identifisert på laboratoriet i 1933, og den første vaksinen ble lisensiert i 1945.
"Vi trenger en bedre vaksine, helt sikkert, det er i det store og hele beskyttende og har mye varig holdbarhet, " sier Dan Jernigan, direktør for CDCs influensadivisjon, som representerte byrået på NIH-møtet. "Hvor langt unna det er, kan jeg ikke si."
**********
Hvis du kunne tverrsnitt et influensavirus, ville det sett omtrent ut som en ball, besatt med molekyler som ligner pigger og sopp. Piggene er hemagglutinin, kjent som H eller HA i korte trekk; soppen er neuraminidase, kjent som N eller NA. Det er 18 undertyper av hemagglutinin og 11 undertyper av neuraminidase, og influensa A-stammer (stammene som forårsaker pandemier) er oppkalt etter kombinasjonene av de to de har. Viruset fra 1918 var en H1N1, 1957 var en H2N2, 1968 var en H3N2. (Innenfor en gitt stamme, som H1N1, kan ytterligere mutasjoner forekomme over tid, spesielt når et fugleinfirus finner veien inn i andre dyr som svin.)
Hemagglutinin er den delen av viruset som lar det binde seg til cellene i lungene våre, for å gjøre dem om til små fabrikker for å lage flere virus. Fordi det er på overflaten av viruset, reagerer immunsystemene våre først på hemagglutinin. Problemet er at viruset kontinuerlig muterer. Antistoffene vi produserer mot denne sesongens hemagglutinin vil ikke nødvendigvis beskytte oss mot fremtidige influensastammer.
Men hva hvis en vaksine kunne lages fra en del av viruset som aldri endres?
"Dette er noe vi bare har vært i stand til å tenke på i løpet av kanskje de siste fem årene, " sier Peter Palese, styreleder for mikrobiologi ved Icahn School of Medicine på Mount Sinai i New York City. "Å forstå viral immunologi, og spesifikt strukturen til hemagglutininer, har latt oss tenke på vaksinekonstruksjoner som vil gi en bredere immunrespons."
 Da Peter Palese forlot Østerrike på begynnelsen av 1970-tallet, var relativt lite kjent om genene som var involvert i influensavirus. Palese utviklet det første genetiske kartet for A-, B- og C-influensastammer. (Bryan Derballa)
Da Peter Palese forlot Østerrike på begynnelsen av 1970-tallet, var relativt lite kjent om genene som var involvert i influensavirus. Palese utviklet det første genetiske kartet for A-, B- og C-influensastammer. (Bryan Derballa) Palese er en av verdens mest markante influensaforskere, med en lang liste over publikasjoner og patenter. Veggene på kontoret hans ved Sinai-fjellet, som vender mot øst-elven og rullebanene til LaGuardia lufthavn, er foret med innrammede priser og grader som er oppnådd og æresbevisende, med sin doktorgrad fra universitetet i Wien i hans hjemlige Østerrike. Han har studert influensa i mer enn fire tiår, opprettet de første genetiske kartene over influensavirus og definert mekanismene til antivirale medisiner. Han var også pioner for en metode for å introdusere mutasjoner i genomet til influensavirus, slik at vi kunne forstå hvordan de forårsaker sykdom.
Paleses ankomst til Mount Sinai i 1971 kom bare fem år før en klynge av tilfeller av influensa oppstod blant militære rekrutter på Fort Dix i New Jersey, en 75 mil kjøretur fra laboratoriet hans. Sakene var forårsaket av en belastning av svineinfluensa; Palese var perfekt plassert til å se den nasjonale panikken da føderale eksperter spådde at en pandemi ville gnist fra den anomale belastningen, og formulerte en nødvaksine. Forutsigelsen deres var feil. Det var ingen pandemi - men det var et samtidig utbrudd av midlertidig lammelse, kalt Guillain-Barré-syndrom, hos mer enn 450 personer som fikk skuddene. Vaksinasjonskampanjen ble avbrutt midt i kaos. Episoden kastet en pall over vaksineundersøkelser mot influensa i år etterpå, mens han søkte på det avgjørende behovet for en vaksine som ikke trengte å bli frisk når en krise truet.
I flere tiår virket en universell formel nesten utenkelig. I løpet av en uke i 2009 kunngjorde to forskere at de hadde identifisert antistoffer som ikke festet seg til lollipop-hodet til hemagglutinin, men til dets stikklignende stilk. Dette var elektrifiserende, fordi stammen av hemagglutinin er "konservert" på teknisk språk: Det er i det vesentlige det samme fra belastning til belastning. Funnene vekket håp om at stamantistoffer ikke bare kunne bekjempe en virusstamme, men mange, og det viste seg å være sant. Forskerteamene avslørte at antistoffene de hadde funnet ga beskyttelse mot en rekke influensavirusstammer.
Men det var ingen åpenbar måte å konvertere det håpet til en vaksine på. Stamantistoffer er sjeldne fordi immunsystemet så sjelden har en sjanse til å reagere på stammen; i møte med influensavirus møter den hemagglutininhodet først. For å gjøre stilken til grunnlaget for en vaksinestrategi, ville forskere måtte utføre en slags kirurgi på hemagglutininer; i en manøvre som å slå en golfball fra en tee, måtte de flytte molekylenes hode ut av veien.
I årene siden disse funnene har forskere prøvd, men ikke klart å fjerne hodet vellykket: En halshugget stamme faller ganske enkelt fra hverandre, og antistoffer vil ikke binde seg til det. Det har også vært lovende prestasjoner, metoder for å forankre stammen av hemagglutinin med konstruerte nanopartikler eller med bytte aminosyrer.
Palese og laboratoriet hans har utviklet en annen strategi. I 2013 fjernet de hodet til et H1-hemagglutinin og erstattet det med hodet til et hemagglutinin fra en egen gren av familien influensavirus - en stamme som berørte dyr, men ikke mennesker. (Forskerne utviklet senere en måte å dyrke disse partiklene fra bunnen av, med de utenlandske hodene allerede på plass.) Substitusjonen var ment å lede immunforsvaret til å hoppe forbi det nye hodet som om det ikke eksisterte, og genererte antistoffer mot stammen i stedet. Stratagemet fungerte. Det kimære hemagglutinin provoserte en immunrespons og beskyttet laboratoriedyr mot infeksjon. En fase 1-prøve har nettopp startet for mennesker.
"Vi har gjort det i mus, hos marsvin, i ilder - der fungerer det fantastisk, " sa Palese. “Men mus er ikke menn; ildere er ikke mennesker. Det må virkelig testes på mennesker. ”
**********
I 1997 kunngjorde et forskerteam ved Walter Reed Army Medical Center at det levendegjør viruset som forårsaket influensa fra 1918.
Forskere hadde aldri klart å forklare hva som gjorde den pandemien så ondskapsfull. Det endte lenge før influensavirus ble isolert i laboratorier. Historiske beretninger vitnet om den raske, dramatiske måten den drepte sine ofre på, men selve viruset virket bestemt å forbli et mysterium. Men på slutten av 1900-tallet avslørte forskere ved Armed Forces Institute of Pathology at de hadde funnet fragmenter av viruset i en langlagret obduksjonsprøve, hentet fra en soldat som døde i 1918.
Ingen i den tett sammensvergede verdenen av influensaforskere hadde jobbet med influensaforskning med dette teamet av molekylære patologer. Det ble ledet av en patolog, Jeffery K. Taubenberger, hvis prestasjoner inkluderte å sette sammen et meslinglignende virus som drepte en pod med delfiner. Nå, bevæpnet med obduksjonsprøven fra den falne soldaten, fikk teamet hjelp fra andre virologer - og fra en pensjonert patolog som dro til Alaska på eget initiativ for å ta vev fra et Inuit-offer som hadde blitt frosset i tundraen for siste åtte tiår. I 2005 var Taubenberger-gruppen ferdig med å rekonstruere hele 1918-viruset og trekke ut dets genomiske sekvens. Den fantastiske bragden oppnådde overskrifter over hele verden. "Den Jurassic Park, Frankenstein ting av å gjenopplive et mordervirus - du kan se hvordan det genererte interesse, " sier Taubenberger. "Men det ble ikke gjort bare for den gitte whiz-faktoren."
 Jeffery Taubenberger forbauset publikum for et tiår siden da han rekonstruerte influensaviruset fra 1918 fra segmenter som ble funnet i lik. Nå bruker han det han lærte for å bygge en ny vaksine. (Eli Meir Kaplan)
Jeffery Taubenberger forbauset publikum for et tiår siden da han rekonstruerte influensaviruset fra 1918 fra segmenter som ble funnet i lik. Nå bruker han det han lærte for å bygge en ny vaksine. (Eli Meir Kaplan) For forskere begynte Taubenbergers arbeid med viruset fra 1918 å åpne den svarte boksen med det som gjorde det så virulent. Det hjalp dem å bedre forstå hvordan influensavirus tilpasser seg mennesker, og hva det kan ta for å forhindre dagens pandemi. Det er ikke lett å besøke NIH-campus; det krever parkering på et sikkert parti, passerer en linje som en innvandringssjekk, skyve vesken din gjennom en skanner og få bildet ditt tatt for en midlertidig ID. Å besøke forskeren som gjenoppsto 1918-influensaen krever mer innsats ennå. Mobiltelefoner tas bort og låses opp - bygningsregler tillater ingen kameraer - og Taubenberger må selv komme til lobbyen og sveipe et merke for å slippe deg inn. På gulvet der han jobber, er det nestede sett med låste dører, netthetsskannere, kodet hengelåser på fryserne og lag av steriliseringssystemer. Sammen inneholder de trusselen som er representert av det rekonstituerte viruset, og andre dødelige virus som krever høye grader av bioinnhold.
Da jeg besøkte, hadde Taubenberger nettopp flyttet til et lite reservekontor som åpnet seg mot rader med laboratoriebenker og avtrekkshetter og rugemaskiner. De fleste av bøkene og forskningsartiklene hans ble ryddet opp i bokser på gulvet. En innrammet plakat støttet til den ene siden reklamerte for en forestilling av en strykekvartett han skrev for mer enn to tiår siden (“Nr. 2 i G-dur”). Taubenberger spiller obo, engelsk horn, klarinett og piano, og han dirigerte overturen til sin første operette ved George Mason University da han var 20 år gammel.
Nå, 56 år gammel, er Taubenberger sjef for den virale patogenese- og evolusjonsseksjonen til National Institute of Allergy and Infectious Diseases, NIH-byrået som Fauci leder. Men andre influensavaksineringsforskere ser fortsatt på bakgrunnen hans som uortodoks, og hans tilnærming er veldig forskjellig fra Palese. "Jeg prøvde ikke å vise meg å være en anti-stilk fyr, " sa han til meg. ”Jeg tror at immunitet mot stilk sannsynligvis vil være viktig. Jeg tror ikke det er den magiske kulen andre mennesker tenker. ”
Taubenbergers versjon av en universell formel henger i stedet på det som kalles “viruslignende partikler”, VLP-er for kort. FDA har allerede godkjent VLP-er for vaksiner mot hepatitt B og HPV. Taubenbergers gruppe bygde på de modellene. For å lage sin første versjon av en universell vaksine, brukte de VLPs som viste hemagglutininer fra fire forskjellige influensastammer som hadde forårsaket tidligere pandemier, inkludert den i 1918. De kombinerte deretter de fire typer VLP-ene til en "cocktail" -vaksine, i håp det vil gi bredere beskyttelse enn sesongvaksiner.
Konstruktet fungerte bedre enn de forventet. Hos mus provoserte det en beskyttende immunrespons mot stammer som hadde noen av disse fire hemagglutininene - og også, til deres overraskelse, mot andre stammer som ikke stemmer overens med vaksinens undertyper. Taubenberger er oppriktig om at han ennå ikke forstår hvordan vaksinen hans påkaller så bred immunitet. "Spørsmålet om hvordan det fungerer for å beskytte alle influensatyper, " sa han, "er noe vi fortsatt jobber med."
Hvis det kan lages en influensavaksine for å beskytte mot alle former for viruset, ville det ikke bare gi mye bedre immunitet, men også endre hele prosessen med hvordan vi administrerer influensaskudd. Det ville gjøre det mulig å gi en vaksine, tidlig i livet, kanskje med periodiske booster-skudd nedover veien. Det ville dekomprimere presset for å vaksinere de utsatte på kort tid før en ny influensasesong begynner.
I likhet med Palese, vil Taubenberger gjerne se at et universelt influensaskudd blir en del av den vanlige vaksinasjonsplanen. Det ville reddet flere liv enn vi antagelig skjønner, la han til. Selv om vi tenker på pandemier som de store morderne, okkuperte de bare i løpet av 100 år siden 1918. "Bortsett fra i 1918, har det sannsynligvis ikke vært noen pandemier i det 20. århundre, eller tidlig på det 21. århundre nå, som har hatt innvirkning høyere enn virkelig dårlige sesonginfluensaår, " sa han. I følge CDC forårsaket pandemien i 2009 mer enn 12 000 dødsfall i USA. "Sesongens flus, " sa Taubenberger, "har rett i det området hvert eneste år."
**********
En måned etter juni-møtet møtte jeg Fauci på NIH-kontoret hans. Han er en immunolog, med en spesiell interesse for HIV - han overtok styreledelsen for NIAID i 1984, i de tidligste dagene av aidsepidemien - og det gir ham unik innsikt i problemene med å oppnå sårt trengte vaksiner. Tross alt var det i 1984 at daværende generalsekretær for helse og menneskelige tjenester Margaret Heckler erklærte at en vaksine mot HIV kunne oppnås "på omtrent to år." Det har det fortsatt ikke.
Siden begynnelsen av den epidemien, ifølge Verdens helseorganisasjon, har om lag 35 millioner mennesker omkommet på grunn av HIV-infeksjon. Det er omtrent en tredjedel av den estimerte bompengene for influensapandemien fra 1918, og disse tallene belyser hvor viktig en universell vaksine ville være.
"Det er fortsatt noen vitenskapelige problemer, " fortalte Fauci meg. “Kan vi virkelig fremkalle et svar som virkelig er tverrbeskyttende mellom stammer? Jeg tror svaret er ja - men jeg kan ikke fortelle deg at vi får en virkelig universell influensavaksine, fordi jeg ikke er sikker på at vi vitenskapelig har bevist at vi kan. "Likevel gjentok han, " Vi må holde oss til den. Med en universell influensavaksine kunne vi ta pandemier av bordet, i stedet for å jage halene våre hvert tiende år om en ny fugleinfluensa eller en ny svineinfluensa. En slik vaksine vil også gi oss mulighet til å gjøre det bedre på sesonginfluensa, så det vil være en tofering. ”
Foreløpig fortsetter Palese og andre å fokusere på å indusere stamantistoffer, mens Taubenbergers gruppe fortsetter å jobbe med sin cocktail-tilnærming, i håp om å starte menneskelige studier om et år eller så. Andre grupper forfølger forskjellige strategier. En tilnærming involverer et protein som kalles matrise 2, som er kodet på influensavirus 'RNA og lar det tømme innholdet i en celle. En annen metode fokuserer på å aktivere T-celler, som dreper celler infisert med viruset.
Uansett hvilken metode som viser seg å være vellykket, og mer enn man kunne, vil den møte det samme problemet: En vaksine er ikke bare vitenskap. Det er også regulering, og produksjon og markedsføring. I disse områdene står en universell influensavaksine overfor utfordringer som er helt adskilt fra de vitenskapelige. Den nåværende, ufullkomne vaksine mot influensa bringer inn over tre milliarder dollar per år over hele verden.
"Den virkelige utfordringen er at det allerede er en etablert, og veldig moden, privat virksomhet som produserer influensavaksine som har på plass et system med årlig levering som garanterer en viss sum, " sa Michael Osterholm, grunnleggeren av senteret for forskning og politikk for infeksjonssykdommer ved University of Minnesota. “Hvordan skal du endre det? Hvem skal betale for det, gitt at kostnadene ved forskning og utvikling kan bety vaksinen blir vesentlig dyrere enn det vi allerede har? Hvilket selskap vil omfavne det? ”
 "Vi må akseptere at det kommer en pandemi, " skrev Michael Osterholm i en innflytelsesrik artikkel fra New England Journal of Medicine fra 2005. “Er det noe vi kan gjøre for å unngå dette kurset?” (Nate Ryan)
"Vi må akseptere at det kommer en pandemi, " skrev Michael Osterholm i en innflytelsesrik artikkel fra New England Journal of Medicine fra 2005. “Er det noe vi kan gjøre for å unngå dette kurset?” (Nate Ryan) I 2012 ga Osterholms organisasjon ut en omfattende rapport som ba om ”spillendrende” influensavaksiner. I den rapporten, og i en bok utgitt tidligere i år, hevdet Osterholm at bare det å produsere nye formler på laboratoriet ikke kan føre til influensavaksinasjon fremover. Han ser for seg både et regjeringsfinansiert Manhattan Project og en filantropisk innsats for å støtte intensiv forskning for en ny vaksine.
Når dette er oppnådd, vil han se offentlig og privat sektor stille noen økonomiske garantier til produksjonsbedrifter om at de vil tjene på å bytte til den nye vaksinen. "Inntil vi gjør det, " sier Osterholm, "influensavaksine er praktisk talt et foreldreløst legemiddel." Med andre ord er det lite insentiv for farmasøytiske selskaper å investere i forskning og utvikling.
Andre nylige vaksinearbeid har ikke møtt de samme utfordringene. To år etter at Ebola herjet i Vest-Afrika produserte et team av forskere fra Verdens helseorganisasjon og Guinea helsedepartementet en vaksine som beskyttet 100 prosent av mottakerne mot infeksjonen. Og mer enn et dusin selskaper kjører nå for å produsere en vaksine mot Zika-virus, som invaderte Sør-Amerika i 2015; en versjon kan nå markedet innen neste år. Denne innsatsen var monumental. Men de kan ikke sammenlignes med søken etter en universell influensavaksine.
Problemet er at influensa ikke er som andre sykdommer. Det er ikke alltid like dødelig som ebola; den er ikke så roman som Zika. Det er en sykdom som er så kjent at vi bruker den som en synekdoche for andre sykdommer - vi holder oss hjemme med "en influensa" som faktisk er forkjølelse, eller blir falt av en "mageinfluensa" som faktisk er en mage-tarmfeil. Og influensa er forårsaket av et virus så formforandrende at vi aldri har kunnet forutse hvilken form det vil ta seg neste gang. Vanskeligheten med å forfølge en universell vaksine mot influensa er ikke bare utfordringen med å lage ny vitenskap. Det er utfordringen å gjenopprette vårt forhold til et patogen som er så nær oss, vi kan ikke se det tydelig.

Abonner på Smithsonian magasin nå for bare $ 12
Denne artikkelen er et utvalg fra novemberutgaven av Smithsonian magazine
Kjøpe