Det er enklere å endre noens genetiske programmering enn du kanskje tror. Mens teknikker for å endre DNA på molekylært nivå blir mer utbredt, er det også mulig å ganske enkelt slå gener av eller på uten å endre det underliggende genetiske materialet permanent. Det betyr at vi kan påvirke de genetiske instruksjonene som blir sendt til en organismes kropp ved å endre miljøet eller med medisiner.
Dette feltet "epigenetikk" hjelper allerede leger med å forstå hvordan visse sykdommer fungerer, hvorfor trening kan være så gunstig og hvordan vi kan være i stand til å endre aldringsprosessen. Men kollegene mine og jeg prøver å undersøke hvilken rolle epigenetics spiller i bakterier.
Vi har nylig studert en mulig måte å påvirke bakterieepigenetika som kan være i stand til å stoppe infeksjoner uten å bruke antibiotika. Og gitt at mange bakterier blir resistente mot eksisterende antibiotika, kan det åpne for en viktig ny måte å behandle sykdom på.
Studien vår så på bakterien Acinetobacter baumannii, som er en hovedårsak til infeksjonene folk kan få på sykehus og som dreper opptil 70 prosent av mennesker som er smittet med den. Antibiotika virker ikke lenger på noen stammer av A. baumannii - og Verdens helseorganisasjon rangerte den nylig som den største bakterielle trusselen mot menneskers helse.
Vi har allerede noen såkalte antivirulensmedisiner som ikke dreper bakterier, men gjør dem ufarlige slik at kroppens immunforsvar kan fjerne dem uten å etterlate noen som blir resistente mot stoffet. Å komme opp med en måte å påvirke bakterienes epigenetika som gjør feilene ufarlige, kan hjelpe oss med å lage nye antivirulensmedisiner som vil gi et enormt bidrag til medisinen.
For å starte denne prosessen vendte vi først til menneskelig epigenetikk. Den vanligste måten å påvirke epigenetikken vår på er å legge til en liten molekylær tagg til genetisk materiale som slår av eller på et beslektet gen. Spesielt kan vi legge til en kode kjent som en acetylgruppe til et viktig protein som heter histon.
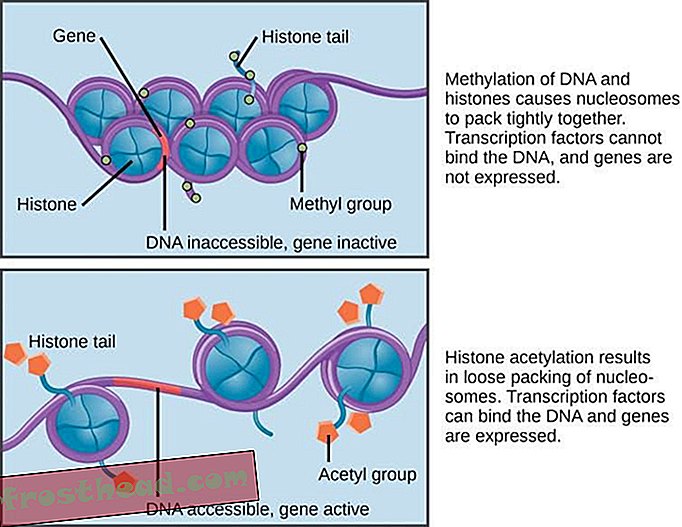 Legge til et acetylmerke til histon (CNX OpenStax, CC BY)
Legge til et acetylmerke til histon (CNX OpenStax, CC BY) Histone organiserer våre 2m lange DNA-molekyler slik at de kan passe pent inn i våre 100 mikrometer lange celler. Å legge til acetyl-taggen er en naturlig mekanisme som brukes av celler for å endre måten histon interagerer med DNA. Å legge til acetyl-taggene aktiverer normalt visse gener, noe som betyr at de endrer måten cellen oppfører seg på. Feil i denne histonmodifiseringsprosessen er knyttet til kreft, hjerte- og karsykdommer og mange nevrodegenerative lidelser.
Bakterieceller har sin egen versjon av histon kjent som HU, som organiserer deres DNA og er involvert i å få alle dens funksjoner til å fungere. Bakterier som blir referert til som “Gram-positive”, for eksempel de i fordøyelsessystemet som hjelper oss med å bryte ned mat, kan ikke overleve uten å jobbe HU. Og "Gram-negative bakterier", som vanligvis er de som gjør oss syke, som Salmonella enterica, blir mye mindre skadelige uten HU.
Nye medisiner
I studien vår fant vi at å legge et acetylmerke til HU betydelig påvirket måten det interagerte med DNA. Dette betyr at det er svært sannsynlig at slik modifisering gjør epigenetiske forandringer, som påvirker hvordan bakteriene vokser og infiserer andre organismer. Så hvis vi kan lage medisiner som gjør disse endringene i bakterieproteiner på denne måten, kan vi ha en ny måte å stoppe infeksjoner på.
Dette er en veldig viktig utfordring innen medisin akkurat nå, fordi bakterier som er resistente mot antibiotika dreper 700 000 mennesker i året over hele verden. Hvis vi ikke finner nye behandlinger, kan den årlige dødsfallet øke til 10 millioner innen 2025.
Når vi har bekreftet koblingen mellom spesifikke epigenetiske forandringer og bakteriell infeksjon, kan vi begynne å lete etter stoffer som endrer bakteriens epigenetikk på denne måten for å gjøre det mindre skadelig. Det er allerede flere molekyler som er rettet mot humant epigenetikk på en lignende måte under preklinisk utvikling eller i kliniske studier. Så et medikament som "slår av" bakterienes evne til å forårsake infeksjoner, er kanskje ikke så langt unna.
Denne artikkelen ble opprinnelig publisert på The Conversation.
Yu-Hsuan Tsai, foreleser i organisk kjemi, Cardiff University

