Det er et fotografi av LaDonna Lopossa som hjelper med å fortelle historien. Hun smiler alle sammen, ligger på gresset på en vagt Betty Grable-måte på sin egen kirkegårdstomt. Portrettet var ektemannens idé - i tiårene deres virker det som om George, alias Mr. No Serious, aldri så en kneble han ikke likte - men det var LaDonna som kom med ostekakeposen.
Relatert innhold
- Høye håp for en ny type gen
- De hemmelige jødene i San Luis Valley
"OK, " hadde George sagt, "nå ta av deg skjorta."
“George”
Klikk.
På den ene siden er det et tullete øyeblikksbilde av en 60 år gammel kvinne i en cardigan og fornuftige sandaler i Winlock, Washington, en solrik dag i mai 2000. På den andre siden er det et glimt av en mulig fremtid der vitenskapen har løst et skremmende problem. For det er slik LaDonna og George møtte hennes dødelige kreft, ikke bare plystret forbi kirkegården, men kløv rundt i den.
Tre måneder før lå LaDonna i en sykehusseng i Olympia i ferd med å tegne gardinen. Det var mye å gi slipp på: fire voksne barn, flere barnebarn, venner i kirken, et godt ekteskap. (Husk at da hun lå der, sa George høyt til sykepleierne at han skulle slå stengene for å finne en annen kone, som hun forsto som hans underlige anstrengelser for å lette tankene.) Hun var klar til å forlate alle og alle de tingene og mer på grunn av smertene.
Milten hennes, normalt gjemt under den nederste venstre ribbein og ikke større enn en fersken, var så oppslukt av hvite blodlegemer at den var på størrelse med en kantalo. Hun kunne knapt gå. Huden hennes var spøkelsesaktig, blodet hennes faretruende kort fra røde celler. Å puste var et ork. Regelmessig oppkast. Knivstikking vondt dypt i beinene hennes, der margen frenetisk trakk ut hvite celler, eller leukocytter. Gjentagende feber. Og kald, merkelig, unnervingly kald : hun fryser under sykehusteppene.
Hun var for gammel og for syk til å gjennomgå en beinmargstransplantasjon, en betryggende, svært risikabel behandling for blodkreft, kronisk myeloid leukemi (CML). Hun hadde allerede prøvd den andre standard CML-behandlingen, vanlige doser av det kraftige sammensatte interferonet. Men det forsterket hennes kvalme, feber og smerter i beinet at hun forlot medisinen, hva som måtte være. Med ingenting igjen i deres leukemi-bekjempende arsenal, var legene nede på Dilaudid, et derivat av morfin, det narkotiske smertestillende. Det var beroligende, det var trøstende og for en pasient i hennes tilstand var det selvfølgelig slutten.
George hadde gitt bort de fleste av eiendelene sine og hadde reservert en lastebil med U-lastebil for å vogne tingene sine til Sør-California, hvor han ville flytte inn hos en av sønnene deres. Musikken til hennes begravelse ble valgt, inkludert “Fordi jeg har fått mye”, som skal synges av barnebarna. Da sykehuset anbefalte å flytte LaDonna til et sykehus, tok George henne hjem i stedet og fulgte legens råd for å tilkalle barna; Terry, Darren og Stephen fløy opp fra Los Angeles-området, og Kelly kjørte bort fra sin plass i Winlock. En etter en gikk de inn på soverommet, satte seg ved sengen på LaDonna og sa farvel.
CML er en av de fire hovedtyper av voksen leukemi, men det er ikke vanlig, og slår 5000 mennesker i USA hvert år. Som regel er det dødelig, med de fleste pasienter som dør i løpet av fem år etter at de ble diagnostisert. Den første fasen, en stealthy eksplosjon av ellers normale hvite blodlegemer, kan vare måneder eller år; pasienter blir ofte varslet om tilstanden ved en rutinemessig blodprøve. Hvis sykdommen ikke sjekkes, blir de hvite cellene stadig mer unormale, og utgir helter-skelter fra bestemte stamceller i benmargen kalt myeloide celler; slike leukocytter sprenger kapillærer, overvelder organer og kveler vev ved å trenge ut oksygenbærende røde blodlegemer. Sykdommens forløp er eksepsjonelt forutsigbar, sier leger, men dens urverkarakter har også gitt forskere en mulighet: å lirke seg inn i de molekylære tannhjulene og fjærene som driver frem CML, de forstår det bedre enn noen annen kreft.
En gang, i begynnelsen av desember 1999, kjørte George for å se LaDonna på sykehuset i Olympia og stoppet på en Safeway for å kjøpe en avis. Mr. No Serious er en ivrig leser, hadde til og med kort drevet en bokhandel med LaDonna, og han slukte avisen på sykehusrommet hennes. Da det skjedde, ble en eksperimentell leukemi-behandling da overskrifter. "Leukemia Pill Holds Promise", rapporterte Associated Press, og sa at CML-pasienter "hadde normale blodverdier i løpet av en måned etter at behandlingen startet." Studien var deretter i gang ved Oregon Health & Science University (OHSU) i Portland.
George skyndte seg ut av sykehusrommet for å finne LaDonnas onkolog.
Mål for intervensjon
En bratt, svingete, trekantet vei fører til hovedcampus, som ligger langs toppen av den 574 fot høye Marquam Hill og på tåkete dager ser ut til å flyte over byen som et slott i en eventyr. En annen rute opp til OHSU er Portland lufttrikk: to sveitsiske produserte gondolbiler av skinnende stål svever på kabler høyt over Interstate 5, som suser folk frem og tilbake mellom vestbredden av Willamette River og en sykehusplattform som ligger nærmere kanten av en klippe enn å gå ut av hjertepasienter kan ønske det skulle være.
Brian Druker ankom OHSU i 1993, år før trikken skulle bygges og hall-of-fame-veggmaleriet i den tilstøtende passasjen ville inneholde et bilde av ham. Høye, så slanke og lette føtter som en gråhund, svakpratende, Druker var 38 år og hadde nettopp tilbrakt ni år ved Dana-Farber Cancer Institute, en del av Harvard Medical School, i Boston. "Jeg så kreft som et problematisk problem, " husket han om forskningsstien han valgte etter endt medisinsk skole ved University of California, San Diego. "Folk begynte å få noen hint og noen ledetråder, og det virket bare på meg at det i løpet av min levetid sannsynligvis ville gi etter for vitenskap og oppdagelse."
På Dana-Farber landet Druker på et laboratorium som studerte hvordan en normal menneskelig celle gir opphav til løpsk vekst - malignitet. Blant annet fokuserte laboratoriet på enzymer, proteiner som endrer andre molekyler ved å bryte dem ned (tarmenzymer, for eksempel, hjelper med å fordøye mat) eller koble dem opp (hårsekkenszymer konstruerer silkeaktige keratinfibre). Enzymer figurerer også i kjedereaksjoner, med ett enzym aktiverende et annet og så videre, inntil noen komplekse cellulære prestasjoner er oppnådd; således kan en celle kontrollere en prosess som vekst eller deling ved å sette i gang en enkelt reaksjon, som å tippe den første dominoen. Under laboratoriesjefen, Thomas Roberts, mestrer Druker en rekke teknikker for å spore og måle enzymer i vevsprøver, og til slutt vende seg til en involvert i CML.
Å jobbe ut detaljene om hvorfor dette spesielle enzymet er nøkkelen til CML hadde involvert hundrevis av forskere over hele verden - forskning som ville føre til flere nobelpriser - men her er egentlig hvor Druker startet:
For det første har alle CML-pasienter det renegade-enzymet i sine hvite blodlegemer.
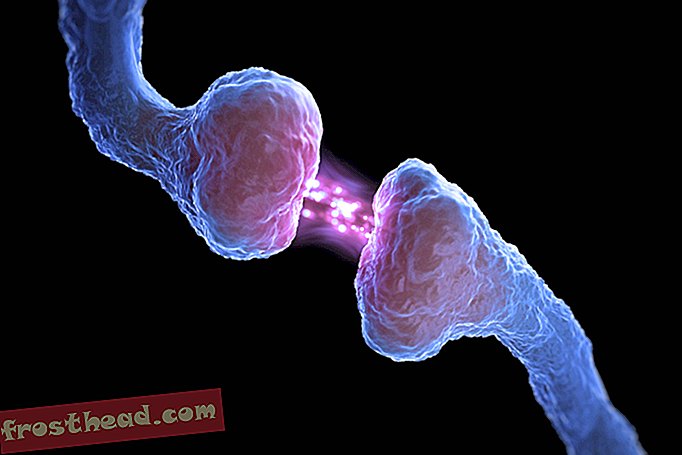
For det andre er enzymet i seg selv et produkt av et freakish gen, kalt BCR-ABL, dannet under en enkelt myeloid stamcelle deling og deretter overført til milliarder av etterkommere: tipsene til to kromosomer, de spindly strukturer som lagrer DNA, bytter faktisk steder, noe som fikk separerte gener kalt BCR og ABL til å smelte sammen (se illustrasjon). Det nye mutant BCR-ABL-genet sitter på et særegent kromosom som ble oppdaget i 1960 av forskere ved University of Pennsylvania. Dette "Philadelphia-kromosomet", synlig gjennom et mikroskop, er CMLs kjennetegn.
For det tredje er BCR-ABL-enzymet den onde tvillingen til et normalt enzym som hjelper til med å kontrollere produksjonen av hvite blodlegemer. Men som en bryter som sitter fast i “på” -posisjonen, ansporer mutanten den ville spredningen som er leukemi.
Du trengte ikke å være Harvard-lege for å se at et enkelt enzym som forårsaker dødelig leukemi var, som forskere sier, et attraktivt mål for intervensjon. Og forskere planla da å finne eller finne opp forbindelser som kunne blokkere BCR-ABL-enzymet.
Druker og hans medarbeidere i Boston, ved hjelp av spesialdesignede antistoffer, utviklet en ny måte å måle enzymets aktivitet på - et verktøy som kan vise seg uvurderlig å evaluere potensielle CML-behandlinger. Druker, som var en slipsslitende lege blant jeankledde doktorgrader, kjørte konkurrenter på andre forskningssentre for å finne et medikament som undertrykker kreft ved å deaktivere et kritisk enzym og skåner sunt vev i kuppet. Tradisjonelt bombet kreftbehandling kroppen med kraftige medikamenter, og dreper både sunne og kreftceller - “cytotoksisk cellegift, ” kaller legene det. Alternativet, målrettet terapi, ville bekjempe kreft bedre med mindre sikkerhetsskader, eller i det minste var det forestillingen som ofte holdt Druker på laboratoriet til kl. 23
Så begynte ting å falle fra hverandre. “Ekteskapet mitt hadde gått i stykker. Jeg var ikke det du vil kalle en hengiven mann. Jeg var en hengiven forsker og vitenskapsmann og lege. Og det tok en toll. ”(Druker og kona splittet seg etter to års ekteskap og ble senere skilt.)
Likevel, med en poengsum av publiserte studier og en nydelig enzymmålingsteknikk å vise for sin innsats, trodde Druker at han var klar til å flytte opp Harvard-stigen fra instruktør til adjunkt. "Jeg satte meg ned med sjefen for medisinsk onkologi på Dana-Farber, " husket Druker. "Han så på cv-en min og sa: 'Jeg tror bare ikke at dette arbeidet kommer til å gå noe sted her.'" Oversettelse: "Jeg ble fortalt at jeg ikke hadde noen fremtid på Dana-Farber."
"Det var forferdelig, " husket han. “Jeg var deprimert. Men det tvang meg til å virkelig si: Tror jeg på meg selv? Skal jeg gjøre det, gjøre en forskjell? ”
Voksende bekymring
En forsker ble bedt om å beskrive Drukers tilnærming og sa at det kokte ned til "utholdenhet og stahet ved ikke å gi slipp på en ide."
"Jeg tror i utgangspunktet at han er en sjenert person, " sa en annen. “Men på dette” - kreftterapi - “han er som en korsfarer.”
"Han tar alt som er komplisert, skyver det i tankene og gir enklest mulig tolkning og intervensjon."
“Når du stiller et spørsmål, er det stillhet i rommet, nesten ubehagelig stillhet, og du er, som om han til og med hørte meg? Han tenker gjennom ting før han gir svar. ”
"Han lar vitenskapen snakke."
Druker vokste opp som den yngste av fire barn i St. Paul, Minnesota, og gikk på offentlige skoler og utmerket seg i matematikk og naturfag. Faren var kjemiker ved 3M, og arbeidet med utskriftsprosesser ble patentert. Moren hans var en hjemmeværende som engasjerte seg i skolestyrets politikk og løp uten hell for statslovgiver. Etter å ha uteksaminert seg med en kjemi fra UC San Diego, ble han værende på, og i 1978, sitt første år på medisinsk skole, skrev han et papir på 16 sider som antydet en fremtid han ville være med på å skape. Skrevet i langhånd med blått blekk på foret foret notatpapir og med tittelen "Kreftkjemoterapi", konkluderte det med at en dag, når virkningen av kreftmedisiner er "forstått i biokjemiske termer, bør kreftkjemoterapi gjøre fremskritt langt utover de fremskritt som allerede er gjort. ”
Etter at Dana-Farber Cancer Institute ga ham rumpa, surret Druker på nytt. "Da jeg flyttet hit til Oregon, var målet mitt å identifisere et legemiddelfirma som hadde et legemiddel for CML og få det inn på klinikken, " sa han.
Han hadde tidligere møtt Nick Lydon, en biokjemiker hos det sveitsiske farmasøytiske firmaet Ciba-Geigy (som ville fusjonere med Sandoz i 1996 for å danne Novartis). Lydon hadde samarbeidet med Roberts, Drukers tidligere laboratoriesjef. “Jeg ringte vennen min Nick på Ciba-Geigy, og han sa: 'Vi har det du leter etter.'” Det ble kalt STI571. Firmaets kjemikere hadde syntetisert det og andre forbindelser mens de søkte etter et nytt betennelsesdempende stoff, men de hadde lært at det også kunne blokkere aktiviteten til enzymer i et reagensglass. Likevel hadde de ikke helt bestemt seg for hva de skulle gjøre med forbindelsen.
I august 1993 mottok Druker sin første mengde flytende STI571 og en annen kandidatforbindelse fra Sveits. Ved hjelp av enzymmålingsverktøyet han hadde hjulpet med å utvikle, bekreftet han at STI571 hemmet BCR-ABL-enzymet sterkt, som tilhører en klasse enzymer kjent som tyrosinkinaser; den andre forbindelsen gjorde det bare svakt. Han helte også minuttmengder STI571 i et brett med fingerbøl-størrelsesbeholdere som holdt væske og levende hvite blodlegemer avledet fra en CML-pasient. Druker hadde håpet at cellenes vekst ville avta eller stoppe. Enda bedre, cellene døde. Dessuten gjorde ingen store mengder STI571 gitt til sunne celler i en tallerken. "Brian sitt bidrag var kritisk, " husket Lydon når han overbeviste selskapet om å "bevege seg i den retningen."
Men selvfølgelig er veien til stiplede forhåpninger brolagt med eksperimentelle medikamenter som så bra ut i et reagensglass, men som mislyktes hos mennesker. Skeptikere påpekte at hundrevis av forskjellige typer tyrosinkinaseenzymer er i arbeid i kroppen, og, la de til, ville ikke et medikament som blokkerte en også blokkere mange andre og utsette fysiologisk ødeleggelse? "Det var mange naysayers som hevdet at det ville være umulig å utvikle spesifikke proteinkinasehemmere" for å behandle kreft, skrev Tony Hunter, en biokjemiker ved Salk Institute i La Jolla, California, i Journal of Clinical Investigation .
Vitenskapelige ideer slår ikke rot som løvetannfrø som fløt på fruktbar jord. De trenger talsmenn, folk som vil vinne . Druker plugget bort og gjorde flere eksperimenter, for eksempel å indusere en form for CML i laboratoriemus og utsette dem for STI571. Det hele bortsett fra eliminert dyres sykdom. "Jeg la sannsynligvis inn 60 til 80 timer i uken, " husket Druker, som på sin knappe fritid konkurrerte i sykkelritt, en idrett som krever en høy toleranse for smerte og en følelse av når du skal bryte ut av pakken. "Mitt liv i de dagene var at jeg skulle jobbe [på laboratoriet], trene, spise og sove." Det som drev ham, sa han, var CML-pasienter som holdt på å dø.
I 1997, etter å ha publisert en rekke studier med medarbeidere i Portland og Sveits, mente Druker at forbindelsen var klar til å bli prøvd på mennesker. Novartis var uenig. For det første, når hunder hadde fått stoffet i intravenøs form, hadde det en tendens til å forårsake blodpropp på slutten av kateteret. Novartis-kjemikere brukte måneder på å reformulere det flytende stoffet som en pille. Men da forskerne ga store doser til hunder, viste dyrene tegn til leverskade. Enkelte selskapets tjenestemenn, husket Druker, anbefalte å slippe prosjektet helt.
Men leverskaden på hjørnetann flammet ham ikke; cellegift er tross alt ødeleggende. "Vi visste hvordan vi kunne gi mennesker giftige kreftmedisiner, " sa han.
Det neste Druker gjorde hadde kanskje ikke vært ulovlig, men det var absolutt ikke kosher. Han gikk forbi Novartis og gikk rett til Food and Drug Administration for å se om han hadde samlet nok data til å starte en menneskelig rettssak. Jeg ringte toksikologen ved FDA og sa: 'Her er problemet.' Og han sa: 'Herregud, du har massevis av data, vi vil sannsynligvis godta denne søknaden.' »Druker fortalte da Novartis hva han hadde gjort. "Jeg fikk meg i litt varmt vann fordi jeg hadde gått bak ryggen."
Til slutt, i juni 1998, med FDA-tillatelse til å fortsette, administrerte Druker STI571 til et menneske, en 68 år gammel Oregon-mann med CML. "Det var nesten antiklimaktisk, " husket Druker, "i og med at vi hadde vært klare i november 1996 og her var det over halvannet år senere."
Han hadde rekruttert to eminente onkologer som hjalp til med å kjøre den kliniske studien, Moshe Talpaz ved MD Anderson Cancer Center i Houston og Charles Sawyers ved UCLA. Alle CML-pasienter som var påmeldt i de tre byene hadde gjennomgått interferonbehandling og enten hadde de ikke klart å forbedre seg eller hadde hatt tilbakefall. Ingen var kvalifisert for en beinmargstransplantasjon.
Etter hvert som STI571-doseringen økte, observerte legene omtrent seks måneder at antall astronomiske hvite blod på nesten 100 000 celler per kubikk millimeter falt til under 10 000, vel innenfor det normale. Analyse av en av de første pasientenes hvite blodlegemer fant ingen tegn til Philadelphia-kromosomet, noe som tyder på at leukemien var blitt stoppet ved kilden. Mer imponerende, uansett spor av BCR-ABL-genet som forble, hadde sluttet å kopiere. "Det var da vi visste at vi hadde noe slikt som aldri hadde blitt sett før i kreftterapi, " sa Druker.
Når ordet spredte seg på Internett, ønsket andre CML-pasienter. Druker presset Novartis for å produsere mer av stoffet. Men Novartis var ikke klar. Stoffet var vanskelig å lage, Daniel Vasella, daværende administrerende direktør i Novartis og nå styreleder, ville huske i sin bok om stoffet, Magic Cancer Bullet . "Heller ikke [medisinen] var høyt prioritert, gitt det lille antall CML-pasienter, " la han til. I tillegg vil det kreve en betydelig investering å bevise at det var både trygt og effektivt. "En alvorlig bivirkning kan utvikle seg hos en av 1000 pasienter, og det ville være slutten av studien, " skrev han.
I september 1999 fikk Druker en e-post fra en 33 år gammel CML-pasient i Montreal, Suzan McNamara. Hun hadde vært på interferon, som hadde undertrykt sykdommen hennes i nesten et år, men nå brølet den tilbake, og hun ville være med i en STI571-rettssak. "Jeg var syk til det punktet at jeg knapt kunne forlate huset mitt, " husket hun til meg.
Druker ringte henne dagen etter og sa at det ville gå måneder før hun kunne melde seg inn i en studie - Novartis hadde ikke forpliktet seg til å produsere mer STI571. Men, la han til, selskapet kan flytte raskere hvis det høres direkte fra pasienter.
McNamara og en venn brukte et nettsted for å opprette en begjæring som ba om at stoffet ble gjort mer tilgjengelig; tusenvis av CML-pasienter godkjente det. Hun sendte det til Vasella med et brev der de sa: "Vi har med økende bekymring sett på vår tro ... at tilførselen av stoffet ikke har vært tilstrekkelig til å utvide forsøkene så raskt som bevisene til dags dato skulle tilsi."
"Brevet kunne ikke ignoreres, " har Vasella sagt. Selskapet økte produksjonen av STI571.
Æren å kunngjøre de tidlige kliniske resultatene falt til Druker. I New Orleans 3. desember 1999 fortalte han et auditorium fullt av hematologer at alle 31 pasienter i studien responderte positivt på STI571, med antall hvite blodlegemer på 30 i løpet av en måned. Pillerens bivirkninger - opprørt mage, muskelkramper - var det onkologene kaller "mild til moderat." Druker sier at han ikke husker den stående ovasjonen.
Funnene var "en molekylær onkologers drøm, " skrev Harold Varmus, som nå leder National Cancer Institute og ble tildelt en nobelpris for forskning som la grunnlaget for STI571s suksess. Medikamentet, minnes han i sin bok fra 2009, The Art and Politics of Science, var "det beste beviset hittil at de mest grunnleggende aspektene ved kreftforskning hadde dramatiske fordeler for pasienter med kreft."
CNN, New York Times, “Good Morning America” og Associated Press dekket gjennombruddskreft.
Fremtidens bølge
Etter at LaDonna Lopossa og barna hennes sa farvel i februar 2000, dro hun ut noen dager til og kom til en avtale i OHSU. LaDonnas onkolog og George hadde klart å få henne inn i den andre fasen av STI571-rettssaken, som ville registrere 500 nye pasienter på et dusin medisinske sentre over hele verden. Hun blandet seg inn på klinikken på George's arm. "Hva har vi fått til?" Sa en av sykepleierne, noe som betyr at LaDonnas død, som virket overhengende, ville telle som et svart merke mot stoffet. Hennes hvite blodtall oversteg 200.000, mer enn 20 ganger normalt. "Det var ingen to måter å gjøre det på, " sa Druker. "Du så på henne og hun hadde problemer."
De undersøkte henne og ga henne en STI571 pille. Hun kastet det opp.
Neste morgen våknet George og LaDonna i søsterens leilighet i Portland og George gjorde LaDonna til en banan-milkshake. Senere samme dag ble STI571-pillen liggende. Og den neste, og så videre.
"I løpet av tre uker var milten hennes tilbake til praktisk talt normal, " sa Druker. “Hun følte seg fantastisk. Hvit telling hadde kommet ned. En Lazarus-lignende effekt. Det var virkelig mirakuløst. ”
Det var i mai samme år at LaDonna og George besøkte kirkegården i Winlock for å plassere blomster på morens gravsted, som ligger ved siden av tomten LaDonna hadde kjøpt til seg selv. "Jeg skulle være i graven, " sa hun til George.
"Vel, " sa han, "siden du ikke er det, hvorfor tar vi ikke et bilde?"
På slutten av vinteren 2001 hadde Druker og hans samarbeidspartnere samlet mye av deres STI571-data: hos omtrent 95 prosent av pasientene hadde hvite blodcellenivåer gått tilbake til det normale, og i 60 prosent ble kromosomet i Philadelphia ikke oppdaget. Selskapet leverte resultatene med sin nye legemiddelsøknad til FDA, som den godkjente om to og en halv måned - til i dag den raskeste medikamentgjennomgangen i byråets historie.
For ti år siden denne måneden kunngjorde den amerikanske regjeringen at stoffet, som Novartis navngav Gleevec i det nordamerikanske markedet (Glivec i Europa), ville være tilgjengelig for CML-pasienter. Det var et avgjørende øyeblikk. Det forrige århundret med kreftbehandlinger - av og til vellykket, basert på prøving-og-feiling-tester, nesten alltid smertefullt - ville være kjent for eksperter som "før Gleevec." Fra da av var "etter Gleevec, " epoken for målrettet terapi. På en pressekonferanse i Washington, DC 10. mai, kalte sekretær for helse og menneskelige tjenester, Tommy Thompson, stoffet for et "gjennombrudd" og "fremtidens bølge." Den daværende direktøren for National Cancer Institute, Richard Klausner, beskrev det som "et bilde av fremtiden for kreftbehandling."
I dag er Suzan McNamara enig i at fremtiden er god. Da hun for første gang reiste til Portland i 2000 for å ta del i Gleevec-studiet, husket hun: “Jeg dro dit med halve håret mitt og var anorektisk, og kunne ikke engang gå en trapp opp. Og jeg kom tilbake på halvannen måned 20 kilo tyngre og full av liv. ”De neste trinnene hennes var å gå på McGill University, studere leukemibehandlinger og få en doktorgrad i eksperimentell medisin. Nå 44, hun bor i Montreal og jobber i Ottawa for Health Canada, et føderalt byrå. Fortsatt på Gleevec løper hun flere mil noen ganger i uken. "Jeg ville gått mer hvis jeg ikke var så lat, " sa hun. I januar 2010 giftet hun seg med sin mangeårige kjæreste, Derek Tahamont, på Hawaii. "Han sto ved meg gjennom hele sykdommen og alt sammen, " sa hun. ”Vi bestemte oss for å hoppe på et fly og gifte oss på en strand, bare oss to. Det var perfekt."
Gleevec har oppfordret folk til å tro at kreft ikke alltid er en dødelig inntrenger som må tilintetgjøres, men en kronisk sykdom som kan håndteres, som diabetes. I oppfølgingsstudier ledet av Druker hadde rundt 90 prosent av de nylig diagnostiserte CML-pasientene som begynte å ta Gleevec overlevd fem år. "Jeg forteller pasientene hvor optimistisk jeg er om deres fremtid, " sa Druker. ”Vi anslår for Gleevec at gjennomsnittlig overlevelse vil være 30 år. Noen som har diagnosen 60 år, kan leve til 90 år og dø av noe annet. ”
Da LaDonna Lopossa var 60 år, husket hun, sa Druker at han ville holde henne i live til hun var 70. Da nådde hun den milepælen. “Jeg mente da jeg fylte 70 år, ” spøkte han med henne da.
LaDonna, nå 71, og George, 68, bor i Battle Ground, Washington, en landlig by 24 miles nord for OHSU, der LaDonna forblir under Drukers omsorg. Lopossas bor i en bungalow i et statssubsidiert boligkompleks overfor gaten fra en familie som holder høner i hagen og lar George dyrke urter. En innrammet bladannonse for Gleevec med LaDonna henger på en stuevegg. To portretter av Kristus nåder en spisestuevegg. George, som er rask med å si at han ikke er religiøs - "ingen vet hvordan Jesus så ut, " han kvitret med LaDonnas ikonografi - har sin egen hage, der han ser på "Family Guy."
LaDonna frivillig ved North County Community Food Bank nede i gaten, i Mormon-kirken hun tilhører, og på telefon råder hun personer som nylig har fått diagnosen CML for Leukemia and Lymphoma Society. En av hennes største utfordringer i disse dager, sa hun, er å overbevise pasientene om å fortsette å ta Gleevec; de har ikke tålt symptomene på fulminerende CML, og noen synes stoffets bivirkninger er irriterende.
Gleevec holdt LaDonnas CML i sjakk i syv år, da sykdommen hennes ble resistent mot stoffet. Heldigvis hadde medisinsk forskere og medikamentbedrifter utviklet to nye CML-medisiner, som hver deaktiverer BCR-ABL-enzymet på en annen måte og kompenserte for en type Gleevec-resistens. Sprycel hjalp ikke LaDonna, men Tasigna gjorde det - i omtrent to år. Nå er hun på sitt fjerde målrettede CML-medikament, bosutinib, som fremdeles er eksperimentelt. "Leukemien hennes er den best kontrollerte den noensinne har vært siden jeg har tatt vare på henne de siste 11 årene, " sa Druker.
Personalisert onkologi
Druker satt ved det lille runde konferansebordet på sitt lille hjørnekontor høyt på Marquam Hill, og sa at han fremdeles studerte CML, i håp om å forstå hvordan eliminere hver siste mutante stamcelle, og han prøvde også å anvende “Gleevec-paradigmet” til andre leukemier. En knall gul sykkel-racing-trøye slitt og autografert av Tour de France-mester og kreftoverlevende Lance Armstrong hang innrammet på veggen. Det var en klar dag og den store vanilje-iskremen fra Mount St. Helens var synlig ut av vinduet mot nord og historiens bokhvite trekant fra Mount Hood kunne sees gjennom vinduet mot øst. Fyren som ikke hadde de rette tingene for å være adjunkt i Harvard, er i dag direktøren for OHSUs Knight Cancer Institute, oppkalt etter Phil Knight, grunnleggeren av Nike og en innfødt Portland, og hans kone, Penny, som i 2008 pantsatte 100 millioner dollar til anlegget. "Brian Druker er intet mindre enn et geni og en visjonær, " sa Phil Knight den gangen.
Honnørene har strømmet inn, inkludert feltets øverste amerikanske pris, Lasker-DeBakey Clinical Medical Research Award, som Druker delte i 2009 med Lydon og Sawyers. Av de mange opptredenene hans i nyhetsmediene ville ingen endre hans liv mer enn en historie om ham i People, "The Miracle Worker", utgitt i februar 2001. Magasinet hadde sendt en reporter ved navn Alexandra Hardy for å intervjue den drakdrepende legen på sykehuset i skyene. De to ble gift i 2002 og er foreldre til Holden, Julia og Claire. Sa Druker: “Jeg har nå muligheten til å fokusere på familie som en prioritet. Jeg kunne ikke ha gjort det for 10 eller 15 år siden. ”
For noen observatører mistet Gleevec-fabelen snart glansen. "'Wonder Drug' for Leukemia Suffers Backback, " rapporterte Wall Street Journal i 2002 når noen pasienter ble resistente mot stoffet eller ikke tålte det. Det virket som om forskere var trege med å produsere andre medisiner som var målrettet mot å temme andre kreftformer, og stilte spørsmål om strategiens løfte. En Time- reporter blogget i 2006 at Gleevec var et "Askepott-stoff" - et glass tøfler som passet en entall kandidat. Sawyers sa at han ble lei av forskere som sa at Gleevec var en engangs, et heldig skudd.
Medikamentets kostnader har vært kontroversiell siden dag 1. Et års forsyning i USA løper nå rundt 50 000 dollar, eller rundt 140 dollar per daglig pille. Det er det dobbelte av den opprinnelige kostnaden, som Vasella hadde forsvart som "høy", men også "rettferdig", fordi stoffet gir pasientene en god livskvalitet og selskapets inntekter undertrykker forskning på andre medisiner. (På spørsmål om årsakene til prisstigningen, nektet en talskvinne for Novartis å kommentere.) Under alle omstendigheter er et medikament som Novartis klarte å utvikle fordi markedet var for lite, nå en blockbuster. I 2010 genererte Gleevec 4, 3 milliarder dollar i salg over hele verden - selskapets nest høyest brutto stoff. For å være sikker, har Novartis gitt gratis eller rabatterte medisiner til pasienter med lav inntekt. I 2010 hjalp selskapet rundt 5000 amerikanske pasienter ved å gi til dem 130 millioner dollar av Gleevec og Tasigna, også et Novartis-stoff.
Men pasienter, leger og andre har lenge klaget på Gleevecs pris. I sin bok fra 2004, The Truth About the Drug Companies, antydet Marcia Angell, tidligere redaktør for New England Journal of Medicine, at Novartis var "kaster" pasienter på Gleevec. Nylig har leger rapportert at pasienter sluttet å ta Gleevec fordi de ikke hadde råd til det, til tross for selskapets hjelpeprogram.
Druker, som sa at laboratoriet hans har mottatt forskningsfinansiering fra Novartis, men verken han eller OHSU noen gang har tjent Gleevec royalty, beklager kostnadene. "Det burde være en overkommelig pris, som vil ligge i området 6000 til 8000 dollar i året, " sa han til meg. "Selskapet vil fortsatt ha rikelig med fortjeneste." Han fortsatte, "Mange kreftmedisiner er nå priset godt ut fra overkommelig rike. Som helsevesenet er vi nødt til å takle det. "
Det vil være mye å hanskes med: det ser ut til at Gleevec ikke bare var et heldig skudd. Bare det at forskere raskt designet nye medisiner for å takle Gleevec-motstand, viser at de i økende grad vet hva de gjør, sa Sawyers, nå ved Memorial Sloan-Kettering Cancer Center. Han ledet en gruppe som var den første som forklarte motstand og var involvert i Sprycels utvikling. "Hvorfor er jeg så optimistisk?" Sa han. "Vi kjenner fienden, og vi vet hvordan vi skal overvinne den."
Faktisk vant flere enzymmålrettede kreftbehandlinger FDA-godkjenning i Gleevecs kjølvann, inkludert medisiner mot bestemte former for lungekreft og kreft i bukspyttkjertelen. Og forskere sier at de blir hørt av behandlinger godt sammen i kliniske studier. Noen melanompasienter hvis sykdom er forårsaket av en kjent genetisk mutasjon ser ut til å dra stor nytte av et eksperimentelt medikament kalt PLX4032. Sawyers studerer en form for prostatakreft som er ansporet av en mutant hormonreseptor, og han sa at kliniske tester av et medikament (kalt MDV3100) rettet mot det er “spennende.” En farmasøytisk bransjeanalyse anslår at legemiddelfirmaer for tiden utvikler og tester nesten 300 målrettede molekylære kreftbehandlinger à la Gleevec.
Arul Chinnaiyan, en forskningspatolog som spesialiserer seg på kreft ved University of Michigan Medical School, i Ann Arbor, er åpenhjertig om Gleevecs innflytelse. "Vi prøver å franchise suksessen, " sa han om forsøkene hans på å anvende den målrettede terapitilnærmingen til solide svulster, som er mer kompliserte enn CML. Hver type solid svulst kan være drevet av flere uønskede enzymer og reseptorer - proteinstrukturer som overfører kjemiske meldinger - og mangfoldet av mutasjoner kan variere fra person til person. Chinnaiyan himself has discovered two different mutant gene fusions analogous to BCR-ABL that appear to drive many prostate cancers. “The thought is if we know these are the molecular lesions, we'll be able to match the drug or combination of drugs appropriately, ” Chinnaiyan said.
Jeg fikk en følelse av det han kaller “personalisert onkologi” en dag på en bryggeripub i Ann Arbor. Over det arrede trebordet som spiste en bacon-cheeseburger og nippet til øl, var Jerry Mayfield, 62, en tidligere tropper fra Louisiana. Diagnostisert med CML i 1999, ble den gang fortalt Mayfield av sin hematolog at han hadde to til tre år å leve. Mayfield spurte om det var eksperimentelle medisiner å vurdere. Legen sa nei. Mayfield sjekket Internett, lærte om STI571, og etter å ha lært seg dataprogrammering mens han bemannet nattbordet på politiets hovedkvarter i Monroe, opprettet et nettsted, newcmldrug.com, for å informere andre pasienter. Hvis han hadde lyttet til hjembyens lege, sa Mayfield, "uten spørsmål ville jeg ikke være her i dag."
Han driver fortsatt nettstedet sitt, og i disse dager bor i Bloomington, Illinois. Han var i Ann Arbor for å se Talpaz, som hadde samarbeidet om de første kliniske forsøkene på Gleevec i Houston, men hadde flyttet til University of Michigan. Han har tatt vare på Mayfield i mer enn et tiår og administrert målrettede terapier i rekkefølge etter hvert som Mayfield ble motstandsdyktig eller ikke lenger kunne tåle dem: Gleevec, Sprycel, Tasigna, bosutinib og nå ponatinib, enda et eksperimentelt kinase-blokkerende CML-medikamentløp gjennom klinisk studier.
Mayfield er "en plakatgutt for CML-terapi, " fortalte Talpaz. "Han har det veldig bra."
Over pubens blaring musikk sa Mayfield om sitt BCR-ABL-gen: "Jeg hadde G250E-mutasjonen - har G250E-mutasjonen - det er derfor jeg ble motstandsdyktig mot Gleevec."
Hans kommentar hørtes ut som noe ut av en tidsmaskin som er programmert til år eller tiår fra nå, når folk nonchalant vil snakke om deres dødelige genetiske mutasjoner og medisinene som demper dem. Det er et bilde Druker ofte trylle. "I en ikke altfor fjern fremtid, " skrev han da han mottok Lasker-DeBakey-prisen, "vil klinikere kunne analysere individeres svulster grundig for molekylære defekter og matche hver person med spesifikke, effektive terapier som vil gi en varig respons med minimal toksisitet. ”
Mayfield har aldri blitt behandlet av Druker, men har konsultert ham. "Jeg satt på mitt lokale onkologkontor for en dag for ti år siden, og mobilen ringte, " sa Mayfield. “Det var Dr. Druker. Jeg hadde sendt ham en e-post. Jeg var lamslått. Jeg sa til onkologen min: 'Det er frekt å svare på denne samtalen, men dette er helten min.' Han er en så snill og blid og dedikert mann, ikke minst arrogant. Han har reddet så mange liv. Alle i landet burde vite navnet hans. Han er den typen idol vi burde ha, i stedet for idrettsstjerner. ”
Mayfields nettsted har et "takknemlig album" dedikert til Druker, fylt med hyllest fra CML-pasienter. Øyeblikksbilde etter øyeblikksbilde viser mennesker som smiler i sterkt sollys - vandre, plante trær, drikke champagne - mennesker som følte seg rørt til å si at de skyldte ham, vel, alt . De sendte inn dusinvis av dikt og limericks, for eksempel denne av en pasient som heter Jane Graham:
Det var en gang en lege som het Brian
På hvilken forskning vi alle stolte
Han visste at vi var syke,
Så han laget oss en pille,
Og nå planlegger vi ikke dyin. '
I motsetning til forventningene
Druker møtte LaDonna Lopossa i undersøkelsesrommet hvor han ser studiepasienter hver torsdag. George, som sier at LaDonna har en "usynkelig-Molly Brown-kvalitet, " hadde kjørt henne ned fra Battle Ground for hennes sjekk. Hun satt i en stol mens Druker hadde på seg en løstsittende mørkeblå drakt, lente seg mot kanten av et eksamensbord. "Jeg ville ikke være her uten deg, " sa LaDonna (muligens til min fordel).
"Vel, du er her, " sa Druker. "Det går bra med deg."
"Jeg danser godt i gatene."
"Flott. Noen problemer?"
"Nei. Jeg har bare et utslett. ”
"Når startet det?"
“For omtrent ti uker siden.”
Han spurte om utslettet, og senere ville jeg forlate rommet slik at han kunne undersøke henne.
“Jobber du fortsatt i matbanken?” Spurte han.
"Jeg holder på med en dag i uken."
"Hvordan går det?"
“Veldig bra.”
"Hvordan går det med energien din?"
“Energien min er lav. Men hjernen min er aktiv. ”
"Du gjør bare spektakulært, leukemimessig."
"Jeg vet det. Jeg kan føle det."
"Hva annet? Spørsmål til meg? ”
"Jeg skal på tur i morgen."
"Til?"
"San Diego og Knott's Berry Farm med alle barnebarna mine." Hun oppdaterte fremgangen deres, og Druker resiterte deres aldre, som for å sjekke at han hadde fakta riktig. Når han henvender seg til forskere på profesjonelle konferanser, viser han ofte bilder av LaDonna og hennes barnebarn. I motsetning til alle forventninger, sier han, begynner hun å se oldebarna hennes vokse opp.
"Jeg har et så fantastisk liv, " sa LaDonna og rev opp. “Og jeg ville ikke ha det. Jeg sa til legene mine: 'Ikke gjør mer med meg.' ”
Da hun dabbet øynene med et vev, nevnte hun sitt første besøk på klinikken, i 2000, da hun knapt hadde kommet seg gjennom døren. "Det var lenge siden, " sa hun til ingen spesielt.
Da sa hun til Druker: "Men det har gått fort, ikke sant?"
“Har det ikke?” Sa han.
Terence Monmaney skrev første gang for Smithsonian i 1985. Han er utøvende redaktør. Portland-baserte Robbie McClaran fotograferte sin adopterte hjemby for november 2010-utgaven.








 LaDonna Lapossa slår en stilling på toppen av kirkegården i 2000. (Courtesy Ladonna Lapossa)
LaDonna Lapossa slår en stilling på toppen av kirkegården i 2000. (Courtesy Ladonna Lapossa)  "Vi ser bare begynnelsen på å matche pasienter med riktig medisin og se raske forbedringer, " sier Dr. Brian Druker. (Robbie McClaran)
"Vi ser bare begynnelsen på å matche pasienter med riktig medisin og se raske forbedringer, " sier Dr. Brian Druker. (Robbie McClaran)  Diagnostisert med leukemi i 1999, ble Jerry Mayfield, hjemme hos ham i Bloomington, Illinois, fortalt at han hadde to til tre år å leve. "Jeg håpet å se tusenårsskiftet, " sier den tidligere statstropperen, som opprettet et nettsted om en ny terapi han begynte å ta. (Tim Klein)
Diagnostisert med leukemi i 1999, ble Jerry Mayfield, hjemme hos ham i Bloomington, Illinois, fortalt at han hadde to til tre år å leve. "Jeg håpet å se tusenårsskiftet, " sier den tidligere statstropperen, som opprettet et nettsted om en ny terapi han begynte å ta. (Tim Klein)  Suzan McNamara, som var alvorlig syk med leukemi, begynte å ta stoffet Gleevec i 2000. Ti år senere ble hun gift på Hawaii. (Høflighet Suzan McNamara)
Suzan McNamara, som var alvorlig syk med leukemi, begynte å ta stoffet Gleevec i 2000. Ti år senere ble hun gift på Hawaii. (Høflighet Suzan McNamara)  "Dette er en veldig spennende tid å være i kreftforskning, " sier Arul Chinnaiyan (her på laboratoriet hans i University of Michigan) som er inspirert av Gleevecs suksess. "Jeg er veldig optimistisk, er teknologien til et punkt der vi kan finne den genetiske opprinnelsen til forskjellige kreftformer." (Fabrizio Costantini / Aurora Select)
"Dette er en veldig spennende tid å være i kreftforskning, " sier Arul Chinnaiyan (her på laboratoriet hans i University of Michigan) som er inspirert av Gleevecs suksess. "Jeg er veldig optimistisk, er teknologien til et punkt der vi kan finne den genetiske opprinnelsen til forskjellige kreftformer." (Fabrizio Costantini / Aurora Select)  "Når du nesten har dødd, får du et annet perspektiv på livet, " sier Lopossa, hjemme hos mannen sin, George. "Du har mer takknemlighet for det vi har." (Robbie McClaran)
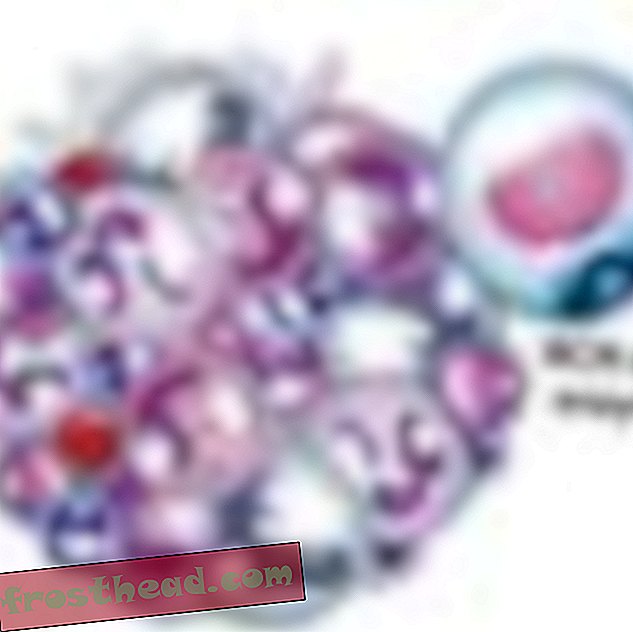
"Når du nesten har dødd, får du et annet perspektiv på livet, " sier Lopossa, hjemme hos mannen sin, George. "Du har mer takknemlighet for det vi har." (Robbie McClaran) 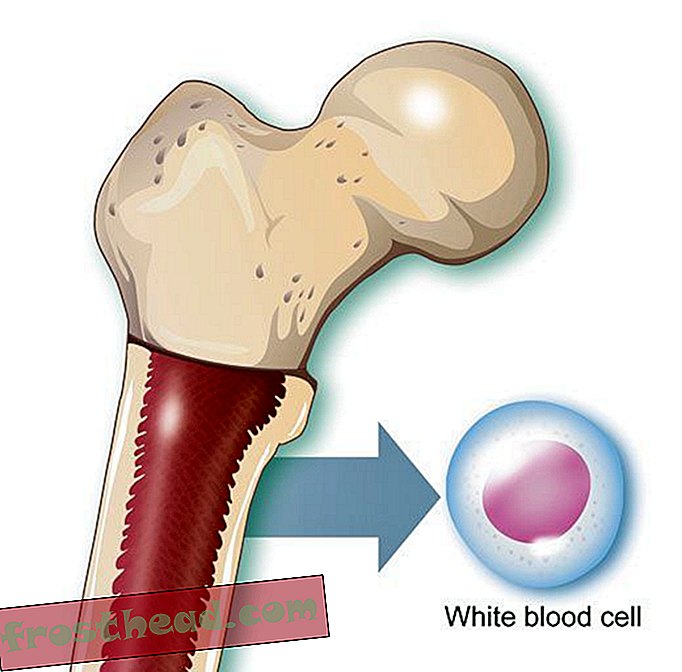 Hva som forårsaker en dødelig blodkreft br> Cell Produksjon br> I benmarg produserer noen stamceller oksygenbærende røde liket, mens andre lager hvite celler, eller leukocytter, som for det meste leger skader og bekjemper infeksjon. Et infisert sår puss er prikket hvitt i stor grad av leukocytter. (Illustrasjon for Smithsonian )
Hva som forårsaker en dødelig blodkreft br> Cell Produksjon br> I benmarg produserer noen stamceller oksygenbærende røde liket, mens andre lager hvite celler, eller leukocytter, som for det meste leger skader og bekjemper infeksjon. Et infisert sår puss er prikket hvitt i stor grad av leukocytter. (Illustrasjon for Smithsonian ) 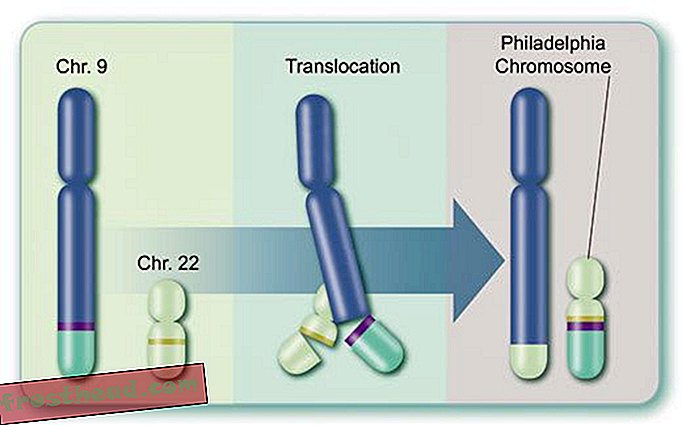 Kromosomer tilfeldigvis krysser stier br> CML oppstår når en stamcelle feil under deling. I stedet for at de 23 kromosomparene dupliseres nøyaktig, bytter biter av kromosomene nr. 9 og nr. 22 steder, og skaper et avvikende "Philadelphia-kromosom" som har et mutant gen. (Illustrasjon for Smithsonian )
Kromosomer tilfeldigvis krysser stier br> CML oppstår når en stamcelle feil under deling. I stedet for at de 23 kromosomparene dupliseres nøyaktig, bytter biter av kromosomene nr. 9 og nr. 22 steder, og skaper et avvikende "Philadelphia-kromosom" som har et mutant gen. (Illustrasjon for Smithsonian ) 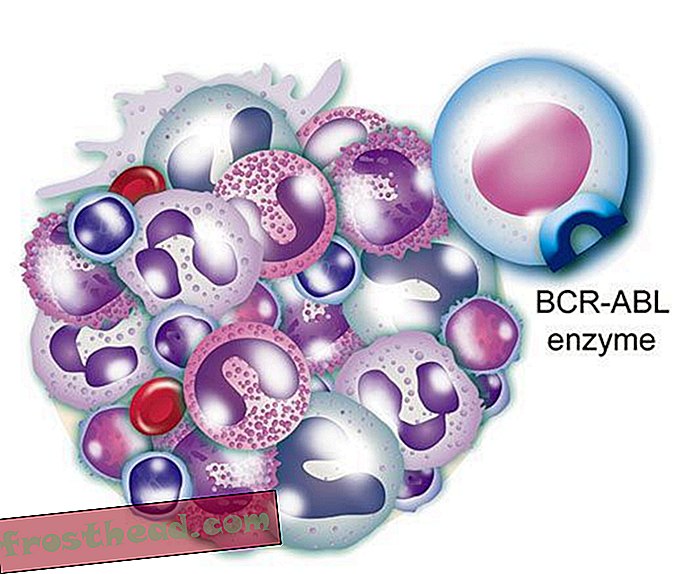 Et medikament som treffer målet br> Det mutante genet produserer et renegade-enzym med samme navn, BCR-ABL. Det ansporer løpende deling av hvite blodlegemer, eller leukemi. (Illustrasjon for Smithsonian )
Et medikament som treffer målet br> Det mutante genet produserer et renegade-enzym med samme navn, BCR-ABL. Det ansporer løpende deling av hvite blodlegemer, eller leukemi. (Illustrasjon for Smithsonian ) 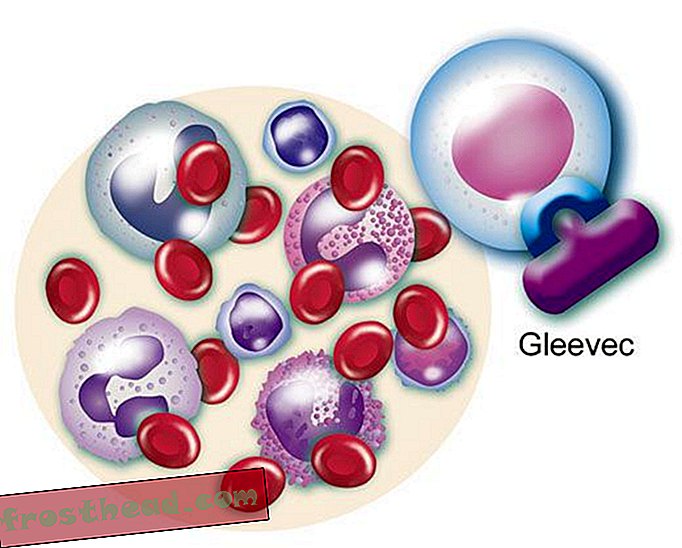 Et medikament som treffer målet br> CML-medikamentet Gleevec blokkerer enzymet lås-og-nøkkel-mote i cellen, og gjenoppretter normal hvitcellevekst. (Illustrasjon for Smithsonian )
Et medikament som treffer målet br> CML-medikamentet Gleevec blokkerer enzymet lås-og-nøkkel-mote i cellen, og gjenoppretter normal hvitcellevekst. (Illustrasjon for Smithsonian )